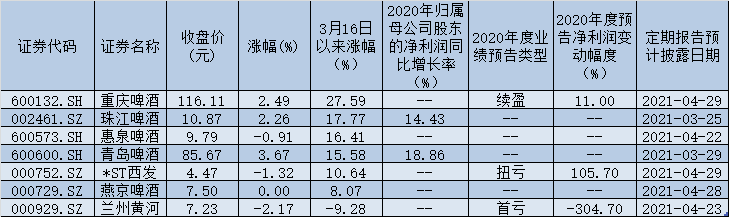
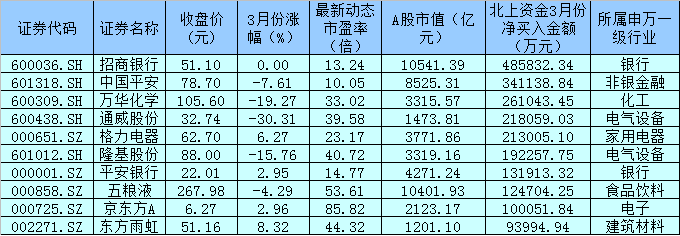
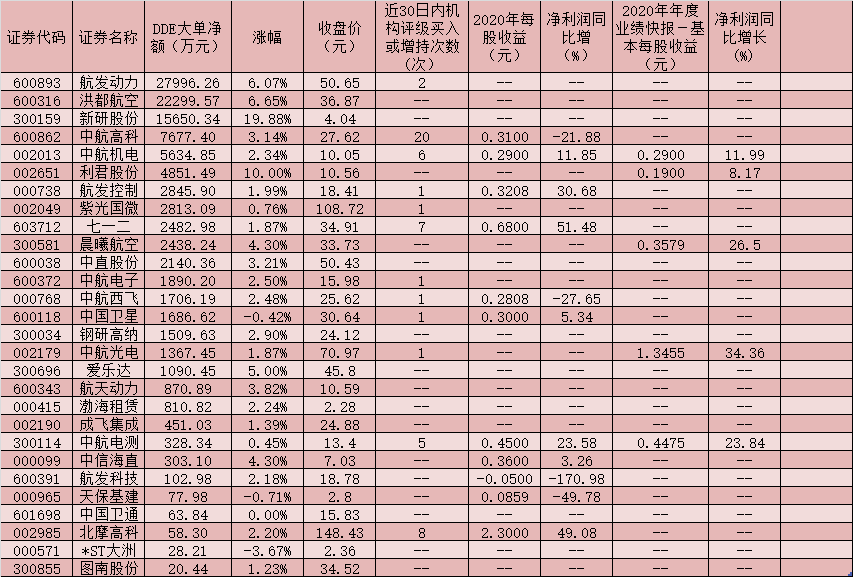
1 月 25日丨海思科(002653,股吧)(002653.SZ)公布,公司全资子公司四川海思科制药有限公司于近日收到国家药品监督管理局下发的《受理通知书》,其申报的HSK29116散剂的药品临床试验申请获得国家药品监督管理局受理。
HSK29116系我公司研发的1类创新化学药,为口服的Protac小分子抗肿瘤药物,可选择性的阻断BTK激酶活性、通过调节信号通路干预B细胞发育,从而控制各种B细胞恶性肿瘤的进展。
HSK29116一方面可通过特异性结合BTK直接抑制BTK活性;另一方面能诱导BTK泛素化标记,通过蛋白酶体途径将其降解,从而阻断BCR信号通路的传递,抑制B细胞淋巴瘤细胞的生长与增殖,起到双重抗肿瘤作用。
目前BTK小分子抑制剂已成功应用于B细胞淋巴瘤的治疗,但现有上市BTK抑制剂主要是通过与BTK活性位点的半胱氨酸残基形成共价键产生酶抑制作用,副作用大,共价结合易产生耐药突变,成为临床治疗中的一大问题。
HSK29116不仅对野生型BTK有更好的药效,同时可克服耐药突变问题。若其成功上市,可为B细胞恶性肿瘤患者带来更多的临床获益和更好的治疗药物。
HSK29116是基于海思科领先的Protac研发平台筛选出的全球首个申报临床的口服BTK-Protac小分子抗肿瘤药物。截至目前,国内外尚无同靶点同机制产品进入临床试验,有望成为firstinclass药物。
鉴于本品良好的竞争态势及市场前景,澳洲、美国临床试验申请也同步进行中。

 猜你喜欢
猜你喜欢 数据显示:2021年国庆档新上
数据显示:2021年国庆档新上 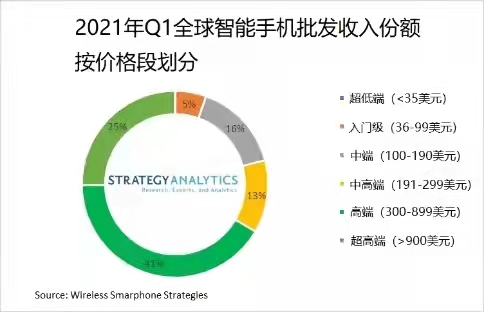 苹果、三星分食高端市场利润
苹果、三星分食高端市场利润  微信拟推出聊天记录付费云存
微信拟推出聊天记录付费云存  个人养老金制度加速崛起 金
个人养老金制度加速崛起 金  飞猪回应 “环球优速通被自
飞猪回应 “环球优速通被自  “泰康919,但愿人长久”:
“泰康919,但愿人长久”:  环信客服云进一步提升基木鱼
环信客服云进一步提升基木鱼  质保索赔、官网均关闭 卖了
质保索赔、官网均关闭 卖了