6月23日,资本邦了解到,首药控股(北京)股份有限公司(下称“首药控股”)回复科创板第二轮问询。

图片来源:上交所官网
在科创板第二轮问询中,上交所主要关注公司合作研发管线、市场空间大、收入确认、CT-707有条件批准上市。
具体看来,关于CT-707有条件批准上市,根据招股说明书及首轮问询回复,2018年6月,发行人与CDE进行了“有条件批准上市”相关申请沟通,CDE回复:“考虑当前的临床需求,以及既往同类药物的临床研发情况,并结合本品前期临床数据,可以接受申请人以单臂试验支持针对克唑替尼耐药的ALK阳性NSCLC患者适应症有条件批准上市,但应同时(上市前)启动在ALK阳性初治患者中,CT-707与克唑替尼比较的优效试验,不接受非劣效设计”。在此次沟通中,CDE确认发行人应在CT-707(SY-707)二线有条件批准上市前启动CT-707(SY-707)与克唑替尼比较的优效试验。
上交所要求发行人进一步说明:发行人SY-707取得CDE同意,在II期临床试验结果达到预期后可申请有条件批准上市,是否需取得单独的临床批件,其依据是否仅为发行人与CDE的线上沟通回复,是否为CDE药品审评审批的惯例。
首药控股回复,SY-707已于2015年10月取得药物临床试验批件(批件号:2015L03333),原国家食品药品监督管理总局同意SY-707开展临床试验,并按照《新药注册特殊审批管理规定》的相关规定,在开展后续临床试验中建立与CDE等监管机构的良好沟通交流机制。
根据批件中的审批结论,公司在开展I期临床试验之前,需要与研究者等协商进一步完善I期临床试验方案;在开展II期、III期临床试验等前,需根据前期获得的研究数据,与研究者等协商制定详细的研究方案和风险控制措施,并经伦理委员会审议后,与CDE进行沟通交流;同时对非临床研究及药学研究等方面提出了一定要求。公司取得临床试验批件后,已开展相应的临床试验,并一直与CDE保持密切的沟通交流。
2018年,公司基于SY-707已有的临床I期研究结果与CDE进行了沟通交流。考虑到当前的临床需求,以及既往同类药物的临床研发情况,并结合SY707的前期临床数据,2018年6月,CDE同意SY-707以单臂试验支持针对克唑替尼耐药的ALK阳性非小细胞肺癌患者适应症有条件批准上市,但应同时(上市前)启动在ALK阳性初治患者中,SY-707与克唑替尼比较的优效试验,不接受非劣效设计。
根据2017年10月中共中央办公厅、国务院办公厅发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》:对治疗严重危及生命且尚无有效治疗手段疾病以及公共卫生方面等急需的药品医疗器械,临床试验早期、中期指标显示疗效并可预测其临床价值的,可附带条件批准上市。
根据2017年12月原国家食品药品监督管理总局药品审评中心发布的《临床急需药品有条件批准上市的技术指南(征求意见稿)》:对于有条件批准临床急需药品上市的申请,申请人可参照《药物研发与技术审评沟通交流管理办法》申请与监管机构的沟通会议,讨论有条件上市许可的可能性及相关要求。
原国家食品药品监督管理总局药品审评中心负责对有条件上市申请进行技术审评,必要时召开专家咨询会对技术问题进行讨论。
根据2019年11月国家药品监督管理局药品审评中心发布的《临床急需药品有条件批准上市的技术指导原则(征求意见稿)》:申请人在附条件批准上市的临床试验开展前,应与国家药品监督管理局药品审评中心进行沟通交流以明确相关问题,沟通会议纪要将作为附条件批准上市申请的受理、立卷审查和审评审批的重要依据。
因此,CDE同意SY-707可在II期临床试验达到预期后申请有条件批准上市,系公司在相关规定指导下,向CDE发起沟通会议交流申请后,CDE通过官方网站下发的正式反馈意见,符合药品有条件批准上市的审评流程,无需另行下发临床批件。此外,根据《关于药品注册审评审批若干政策的公告(2015年第230号)》:对新药的临床试验申请,实行一次性批准,不再采取分期申报、分期审评审批的方式;审评时重点审查临床试验方案的科学性和对安全性风险的控制,保障受试者的安全。加强临床试验申请前及过程中审评人员与申请人的沟通交流,及时解决注册申请和临床试验过程中的问题。综上,公司SY-707已经取得临床试验批件,获准开展相应临床试验,无需就有条件批准上市事项单独取得批件,此举符合CDE药品审评审批的惯例。
关于市场空间大,根据招股说明书及问询回复,考虑到SY-707、SY-3505有望分别作为第二个国产上市二代ALK抑制剂和首个国产三代ALK抑制剂上市,按照国产市场份额30%-40%及国产占全部市场50%的份额预计,SY-707和SY-3505合计在2024年-2030年间有可能达到12.33亿元-34.70亿元的峰值销售规模,符合“市场空间大”的要求。
上交所要求发行人进一步说明:上述相关数据测算的依据,以及结合适应症的市场空间容量、市场竞争情况,进一步论述“市场空间大”的理由,并对相关数据的来源、测算依据进行标注说明。
首药控股回复称,发行人核心产品SY-707、SY-3505所在的领域为ALK阳性非小细胞肺癌领域,小分子ALK抑制剂已成为ALK阳性转移性非小细胞肺癌的标准治疗,被证实在疗效上显著优于化疗1,ALK阳性非小细胞肺癌治疗领域生物药适用极少,仅有贝伐珠单抗在部分场景下可与含铂双药化疗联用进行一线或二线治疗,目前未查询到以ALK阳性非小细胞肺癌为适应症的临床阶段在研生物药。含铂双药化疗是晚期非小细胞肺癌标准一线化疗方案,但其在治疗ALK阳性非小细胞肺癌领域治疗效果不佳。
近年来,非小细胞肺癌已进入精准诊断与治疗时代,在小分子ALK靶向药物上市后,ALK抑制剂靶向治疗被各大权威指南迅速列为针对ALK阳性非小细胞肺癌患者的首要推荐疗法,由上述NCCN指南和CSCO指南的推荐疗法变化可见,当前对ALK阳性非小细胞肺癌患者,小分子靶向抑制剂是标准治疗方法和首选推荐药物,生物药在ALK阳性非小细胞肺癌治疗领域,临床疗效及指南推荐优先级均不及小分子靶向抑制剂。
CSCO指南亦将ALK小分子抑制剂作为ALK阳性非小细胞肺癌治疗一二线首要推荐疗法,但2018年以前,由于ALK靶向抑制剂药物在中国价格昂贵,中国ALK阳性非小细胞肺癌病人对此类药物可及性低,为避免该类患者无药可用,基于资源可及性考虑,CSCO指南在2016年版本中将非靶向的化疗药物与贝伐珠单抗联用列入ALK阳性非小细胞肺癌治疗的“可选策略”,并写明“基于经济原因或患者个人意愿可选”。
2018年克唑替尼进入中国医保目录,2019年阿来替尼及塞瑞替尼进入中国医保目录后,中国ALK阳性非小细胞肺癌病人对小分子ALK靶向抑制剂药物可及性大大增加,化疗±生物药已逐步退出ALK阳性晚期非小细胞肺癌药物市场,对小分子ALK抑制剂不存在竞争优势。
因此,发行人核心产品SY-707、SY-3505所在的ALK阳性非小细胞肺癌领域生物药适用极少,仅有贝伐珠单抗在部分场景下可与含铂双药化疗联用进行一线或二线治疗。在ALK阳性非小细胞肺癌治疗领域,生物药临床疗效及指南推荐优先级均不及小分子靶向抑制剂,仅作为患者无靶向药使用时的备选方案,ALK阳性非小细胞肺癌药物市场主要被小分子靶向药物占据,生物药相比对小分子ALK抑制剂尚不存在竞争优势。
当前已上市及临床在研ALK抑制剂均为小分子靶向药物,不存在生物药,发行人在招股说明书及首轮反馈回复中披露的中国ALK抑制剂市场规模即为中国ALK小分子靶向药物市场规模。根据弗若斯特沙利文分析,中国ALK抑制剂市场具有较大的市场需求和发展潜力,2020年,中国ALK抑制剂市场规模为30.34亿元,相比2019年增长60.53%。2024年中国ALK抑制剂市场规模预计将达到72.5亿元,2019年至2024年复合年增长率预计为30.9%。预计到2030年中国ALK抑制剂市场将达到138.8亿元,2024年至2030年中国ALK抑制剂市场的复合年增长率预计为11.4%。上述测算不包含生物药产品市场。
国产药物在有效性、安全性上与进口药物体现出至少相当的竞争力,且具备研发成本优势、生产成本优势、商业化优势和本土政策优势,在占据市场份额方面具有本土优势,综合预测ALK领域国产药物能够占据未来50%市场份额具有合理性;此外,EGFR抑制剂市场与ALK抑制剂市场具有高度相似性,EGFR市场已形成国产药物为主导的市场格局,参考EGFR抑制剂市场,预测ALK抑制剂市场未来能够形成国产药物占据50%份额的竞争格局具有合理性。
二代ALK抑制剂在有效性和安全性上均超越了一代药物克唑替尼,根据《NCCN指南(2020)》,ALK重排阳性的患者无论在一线化疗前或化疗时发现ALK阳性,均应首选阿来替尼、布加替尼、劳拉替尼、塞瑞替尼、克唑替尼作为一级推荐药物(以上均为1类证据)。根据《CSCO指南(2020)》,ALK融合阳性的晚期非小细胞肺癌患者应首选阿来替尼及克唑替尼作为一线治疗推荐药物。由此可见,二代药物已成为权威指南当前首要推荐的药物品类。根据2020年全球ALK抑制剂销售情况统计,二代抑制剂占据全球ALK抑制剂市场份额超过59%,占据中国ALK抑制剂市场份额的51.5%,二代ALK抑制剂已在全球和中国范围内占据销售规模优势。劳拉替尼、SY-3505等三代抑制剂可覆盖一代、二代抑制剂耐药的突变位点,对ALK患者延长生存期和生存质量具有稀缺性和不可替代性,长期销售增长潜力巨大。
如前所述,肺癌是中国发病率最高的癌种,在肺癌靶向治疗领域,ALK变异系当前第二大市场规模突变靶点,而且ALK阳性患者往往对化疗不敏感,其抑制剂市场空间广阔。根据弗若斯特沙利文预测,2024年中国ALK抑制剂市场规模预计将达到72.5亿元,2030年中国ALK抑制剂市场将达到138.8亿元。
药物研发领域国际顶尖综述期刊NatureReviewsDrugDiscovery2分析了1998至2009年,由美国FDA标准审查(剔除突破性疗法等疗效有明显优势的品种)获批上市的50个药品(包括29个同类第二、13个同类第三和8个同类第四)的美国市场份额峰值和市场推广费用占比的关系,同类第二平均市场份额峰值为34%。
考虑到国内尚未有充分权威的借鉴数据,参考美国市场相关情况,SY-707是当前国产二代ALK抑制剂领域除已上市的恩沙替尼外,唯一取得二期有条件批准上市资格的在研药物,SY-3505是首个进入临床阶段的国产三代ALK抑制剂,综合考虑当前临床进度格局,预测SY-707有望为国产同类第二个上市二代ALK抑制剂,SY-3505有望为国产同类第一个上市三代ALK抑制剂3,参考上述平均市场份额峰值情况,保守预测SY-707与SY-3505在国产ALK抑制剂市场中最高合并占有30%-40%的市场份额。
鉴于全球首个三代ALK抑制剂劳拉替尼上市时间较短,尚未形成稳定市场销售份额,且尚未在中国上市销售,因此公司三代ALK抑制剂在研产品SY3505难以独立进行准确的可比市场预测。虽然SY-707与SY-3505属于不同代的ALK抑制剂,但鉴于ALK抑制剂在临床应用时会兼顾序贯治疗和交替使用,较难在市场预测时根据药物代数进行清晰划分,为保守及准确起见,发行人对SY-707及SY-3505的市场规模进行合并预测。
根据美国医药研发领域专业咨询公司Pharmagellan发表在NatureReviewsDrugDiscovery的分析论文,该文章统计了61款美国上市药物在上市后达到销售峰值的时间分布情况,发现不管是首创药物、me-too类药物、化学药或生物药,药物销售额达峰时间的平均值大约是上市后的5-6年。SY-707预计于2022年提交NDA,2023年上市,SY-3505预计于2024年上市,因此假设SY-707与SY-3505于2028年-2030年间达到合并销售峰值。
根据上述分析,假设国产药物占据ALK整体市场的份额分别为40%-60%,SY-707及SY-3505合计占有国产药物的市场份额为30%-40%,相应占据ALK整体市场的份额为12%-24%,对SY-707及SY-3505以乐观情景和悲观情景进行预测,SY-707和SY-3505合计在2028年-2030年间有望达到14.22亿元-33.31亿元4的峰值销售规模(具体见下表所示),符合“市场空间大”的要求。

 猜你喜欢
猜你喜欢 数据显示:2021年国庆档新上
数据显示:2021年国庆档新上 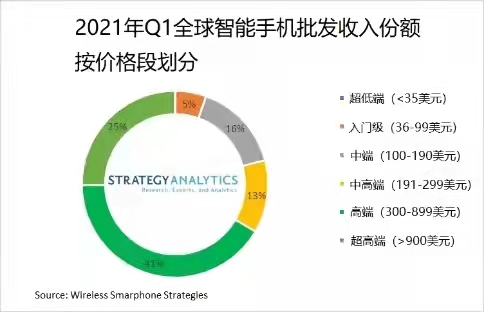 苹果、三星分食高端市场利润
苹果、三星分食高端市场利润  微信拟推出聊天记录付费云存
微信拟推出聊天记录付费云存  个人养老金制度加速崛起 金
个人养老金制度加速崛起 金  飞猪回应 “环球优速通被自
飞猪回应 “环球优速通被自  “泰康919,但愿人长久”:
“泰康919,但愿人长久”:  环信客服云进一步提升基木鱼
环信客服云进一步提升基木鱼  质保索赔、官网均关闭 卖了
质保索赔、官网均关闭 卖了